大学生向け・電子軌道を分かりやすく

閲覧ありがとうございます。
爺さんです。
この記事を読めば
・s軌道やp軌道とは何者か?
・「スピン」とは何か?
・「sp3混成軌道」とは何か?
といった疑問を解決することができます。

Contents
復習しよう(電子殻の構造)

早速ですが、本記事を読むにあたって
最低限必要な知識を確認しておきましょう。
高校ではこういう事を習いました。
大学で習う「電子軌道」では
この知識をもう少し深堀りしていくイメージになります。
基礎をつかもう
基礎① s軌道やp軌道って何者?
結論から言うと、
電子が存在しやすい領域の一つをs軌道やp軌道と言います。
例えば、K殻の電子は「1s軌道」という領域に電子がいやすいです。
L殻の電子は「2s軌道」もしくは「2p軌道」という軌道にいやすいです。
M殻の電子は「3s軌道」もしくは「3p軌道」もしくは「3d軌道」という軌道に存在しやすいです。
ちなみに、軌道の名前についている数字nは主量子数と言います。
K殻はn=1、L殻はn=2、M殻はn=3です。
この周期表 (Japanese Periodic Table)を見れば
全元素の電子軌道を見ることができます。
電子はこれらの軌道のうち、
エネルギーの低い軌道から順番に入っていきます。
1s<2s<2p<3s<3p<4s<3d<4p
試しに、Liの電子軌道を考えてみましょう。
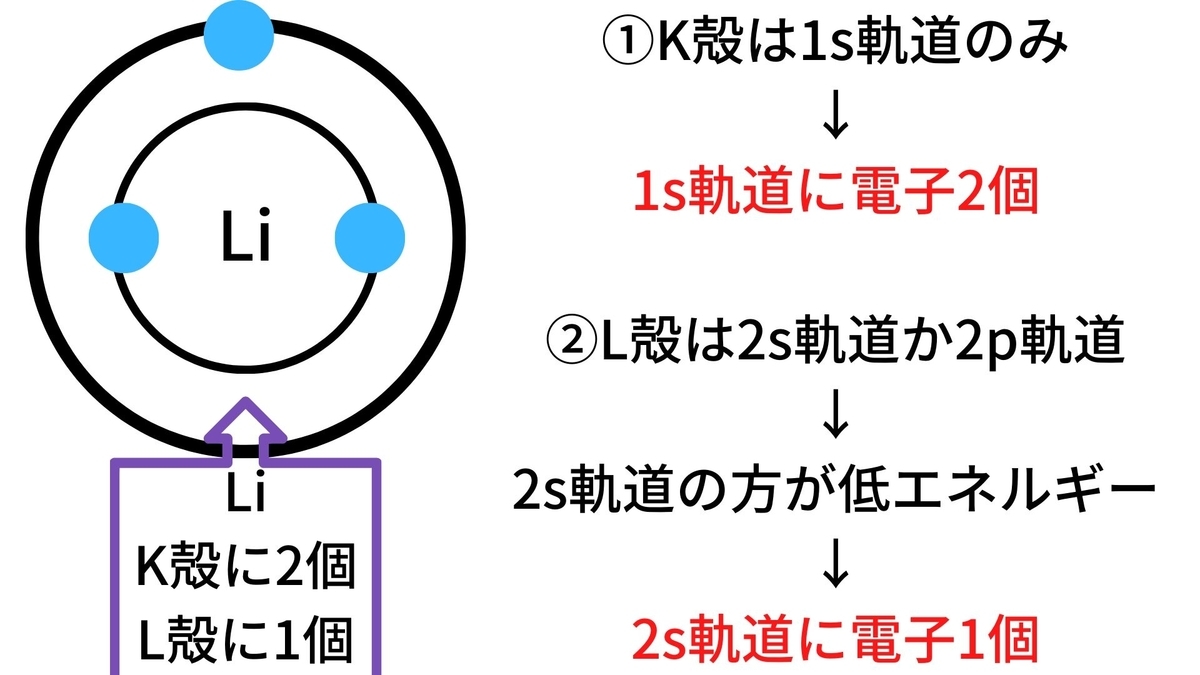
つまり、Liの電子は
「1s軌道に2個、2s軌道に1個」存在する確率が高い
ということになります。
基本的な考え方は以上です。
次の小節に移る前に、もう一度周期表 (Japanese Periodic Table)
をチラッと見ておいてください。
見るポイントは上下の矢印↑↓です。
基礎② 「スピン」って何?

電子のスピンとは、電子の自転のことです。
実は電子というものは
地球と同じように自転しています。
先ほど見てもらった上下の矢印↑↓は
二つの電子のスピンの向きが逆向きであることを示しています。
基礎③ 電子軌道の2つの法則
必ず覚えないといけない法則を簡単に説明します。
2つの法則とは、
・パウリの排他原理
・フントの規則
です。

ここで、超重要な補足説明をします(もはや補足ではない)
p軌道は一つではありません。
どういうことかというと、
s軌道は1つの球形の軌道なのに対して
p軌道は方向の異なる、3つのアレイ型軌道からなっている
ということです。
一つの軌道に2つの電子が入れるので、
s軌道:2個×1軌道=2個入れる
p軌道:2個×3軌道=6個入れる
ということになります。
だから、s軌道とp軌道から成るL殻には
2+6=8個の電子を入れることができるというわけです。
ただし、「一つの軌道に電子を2つ入れたいならスピンは逆にしなさい」
と言っているのが「パウリの排他原理」
「p軌道みたいに複数の軌道を持っているところに電子を入れるなら、とりあえず同じ向きで一つずつ入れなさい」
と言っているのが「フントの規則」
になります。
イメージできない!という人は
周期表 (Japanese Periodic Table)で「原子軌道」をクリック。
パウリの排他原理→「Li→Be」あたりを見よ!
フントの規則→「B→C→N→O」あたりを見よ!
例外を知ろう

化学に例外は付き物。
電子軌道の世界にも、パウリの排他原理やフントの規則に沿わない
現象が存在します。
例外① 炭素Cの電子軌道ーsp3混成軌道
炭素は場合によっては例外的な電子配置を取ります。
再度周期表 (Japanese Periodic Table)を見てみましょう。
炭素の電子は1s軌道に2つ、2s軌道に2つ、2つの2p軌道に1つずつ入っています。
これはきちんと規則に沿った、期待される結果です。
しかし、原子の結合力が増すときなど、場合によっては
炭素の電子は1s軌道に2つ、2s軌道に1つ、3つの2p軌道に1つずつ入ります。
つまり、低エネルギーの2s軌道の電子が1つ、高エネルギーの2p軌道に移動するわけです。
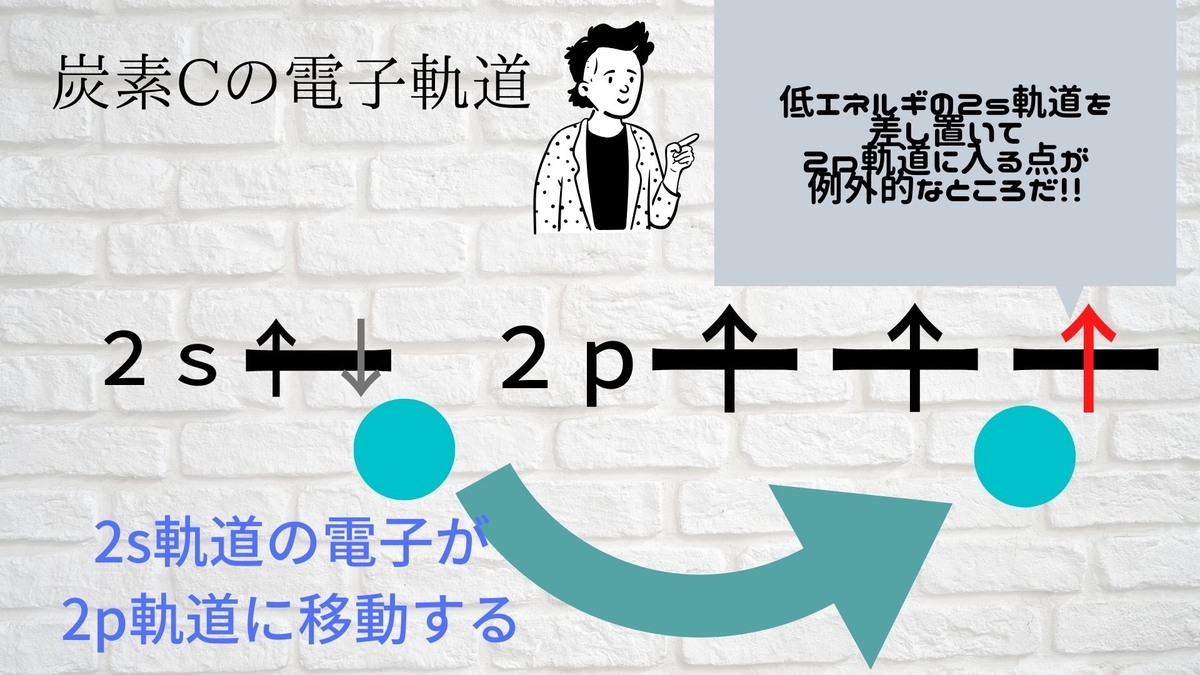
本来は混ざりあうはずのない、1つのs軌道電子と3つのp軌道電子が混ざりあってできた軌道なので
「sp3混成軌道」と言います。
炭素の他にも、ケイ素Siなどでも見られます。
もっと深く知りたい人へ

もっと深く知りたい人にオススメの書籍を紹介します。
書籍① 「シュライバー・アトキンス 無機化学 上」
この書籍の良いところは
・イラストが多く、見やすいデザイン
・例題が豊富→自分の理解度を確認できる設計
です。
商品リンクを貼っておきますので
良かったらチェックしてみてください。
 | 【送料無料】 シュライバー・アトキンス 無機化学 上 / P.W.atkins 【本】 価格:7,150円 |
書籍② 「サイエンスビュー 化学総合資料」
この書籍の良いところは
・文字<イラスト→読んでいて飽きないデザイン性
・高校生向けの内容なので大学生にとってはとても理解しやすいところ
です。
商品リンクを貼っておきますので
良かったらチェックしてみてください。
 | サイエンスビュー化学総合資料【合計3000円以上で送料無料】 価格:913円 |